近日,Journal of Agricultural and Food Chemistry在线发表了江南大学未来食品科学中心陈坚院士团队赵鑫锐研究员课题组的研究成果“Engineering Corynebacterium glutamicum with Effective Heme Supply for the Synthesis of High-Activity Hemoglobins and Myoglobins”吉林大学/江南大学联合培养的2022级博士生王松为论文第一作者,江南大学赵鑫锐研究员与吉林大学李正强教授为论文通讯作者。
血红蛋白(Hemoglobin,Hb)与肌红蛋白(Myoglobin,Mb)是由珠蛋白与血红素(Heme)复合形成的功能性血红素蛋白,在无细胞氧载体、铁补充剂和生物催化等领域具有重要应用价值。特别是植物源血红素结合蛋白(如大豆血红蛋白S-Hb、三叶草血红蛋白C-Hb)及动物源血红素结合蛋白(如牛肌红蛋白B-Mb、猪肌红蛋白P-Mb)因其天然、安全特性,被广泛用作食品级着色剂与风味改良剂,可显著提升植物基人造肉的色泽与口感拟真度。然而,微生物合成Hb和Mb仍然面临蛋白合成水平低和heme供给不足的瓶颈,阻碍了其商业化应用。
针对上述问题,研究团队构建了高效合成高活性Hb/Mb蛋白的谷氨酸棒杆菌底盘菌株(图1)。首先,通过优化质粒骨架、启动子和无前导双顺反子序列,并引入提高质粒拷贝数的碱基点突变,大幅提升了Hb和Mb的表达水平。随后,为满足血红素结合蛋白对heme辅因子的需求,研究团队提出了基于代谢流分析的定制化迭代模块优化策略(CIM-MFA),该策略将复杂的heme途径划分为三个模块,基于代谢流实时分析heme合成途径的代谢瓶颈,逐步提高heme供给(图1)。
代谢流分析发现heme途径中的整体碳流量低,因此通过筛选不同物种来源的C5途径并过表达最优C5途径,显著提高了5-氨基乙酰丙酸(ALA)供给。此外,ALA向UPG III(尿卟啉原III)转化过程中不稳定中间体羟甲基胆色烷(HMB)自发氧化为有毒副产物UPG I,因此通过将自组装短肽RIAD和RIDD分别融合于HemC和HemD的C端,拉近了二者的空间距离,使得副产物UPG I的积累量降低了95.49%。另外,CPG III(粪卟啉原III)向heme转化存在严重的限速步骤,通过对比heme下游合成的粪卟啉依赖(CPD)和原卟啉依赖(PPD)途径的转化效率,确认了谷氨酸棒杆菌内源性的CPD途径为优势途径。随后通过鉴定和过表达CPD途径关键限速酶HemH和HemQ,使heme含量提高了18.70倍。为最大限度将heme留存在胞内以满足血红素结合蛋白的需求,敲除了谷氨酸棒杆菌血红素转运蛋白HrtBA,使得heme含量提升了28.70%。最终工程菌株HEME3-ΔhrtBA的heme含量较野生型菌株提高90.75倍。
应用最优的血红素蛋白表达策略,工程菌株HEME3-ΔhrtBA在摇瓶水平实现了多种血红素结合蛋白的合成,包括:S-Hb(1.10 g/L),C-Hb(1.12 g/L),B-Mb(0.56 g/L)和P-Mb(1.14 g/L)。谷氨酸棒杆菌合成的Hb和Mb与天然的牛血红蛋白(B-Hb)和马肌红蛋白(H-Mb)具有相似的heme结合率和过氧化物酶活性。本研究构建的工程菌株为合成各种功能性的Hb和Mb提供了一个可扩展的平台。
上述研究工作得到了国家重点研发计划(2024YFA0919900)、宁波市重点研发项目(2025Z103)、江苏省合成生物学基础研究中心(BK20233003)和国家轻工业技术与工程一流学科(LITE2018-08)等项目的资助。
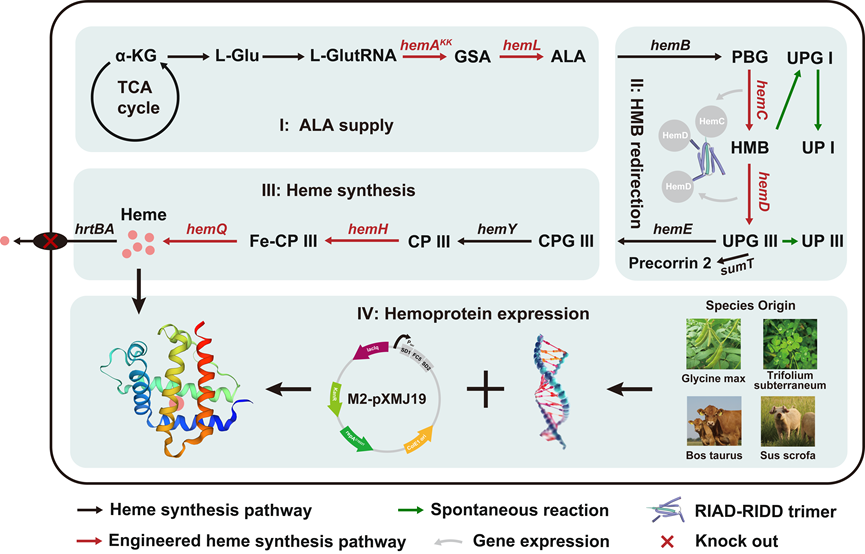
图1 高效合成高活性Hb和Mb的代谢改造策略
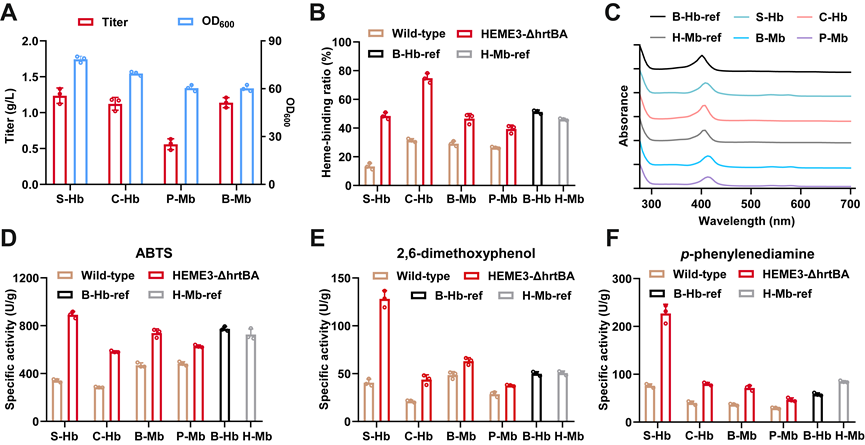
图2 生物合成的Hb和Mb的产量和酶学性质
(编辑:潘梦妍)
