近日,Nature Chemical Biology在线发表了江南大学未来食品科学中心和生物工程学院陈坚院士团队刘龙教授课题组的研究成果“CRISPR/dCas12a-mediated genetic circuits cascades for multiplexed pathway optimization” (Wu et al., Nature Chemical Biology. 2023. 10.1038/s41589-022-01230-0)。江南大学2021级博士后武耀康为论文第一作者,刘龙教授为论文通讯作者。
利用合成生物学技术创建和优化微生物细胞工厂,可以实现化学品、食品、药品等产物的绿色生物合成。由于细胞代谢具有高度复杂性,在微生物细胞工厂的代谢调控中常需要协调优化多个基因的表达水平。然而,目前常用的基于小RNA(sRNA)或CRISPR/dCas9的多基因调控策略需要引入重复的启动子或其他大片段外源序列,并不利于细胞工厂中多个基因的组合优化调控。
为解决上述难题,该研究以模式工业微生物枯草芽孢杆菌(Bacillus subtilis)中6-磷酸氨基葡萄糖(GlcN6P)的生物合成为例(图1a),提出了一个“设计-构建-测试-学习(Design-Build-Test-Learn)”框架,用于实现CRISPR/dCas12a级联基因回路介导的多途径组合优化调控。具体包括四个方面:
(1)在设计(Design)阶段,设计并创制了生物传感器信号放大电路(biosensor-signal-amplifying-circuits, BSAC)、正反馈基因调控电路(genetic-regulation-circuits, GRC)和时期依赖型GRC三个基因回路(图1b);其中,基于T7 RNA聚合酶(T7 RNA polymerase, T7RNAP)的BSAC用于胞内GlcN6P浓度向荧光信号的转化与放大(图2a-d),正反馈GRC用于解除GlcN6P合成途径中反馈抑制(图2e-g),时期依赖型GRC用于生长所需竞争途径的自发弱化(图3)。
(2)在构建(Build)阶段,将上述三个基因回路级联整合到枯草芽孢杆菌细胞中得到GlcN6P合成与筛选所需的平台菌株(图1c)。随后,以GlcN6P合成的三个竞争模块(磷酸戊糖途径HMP、糖酵解途径EMP和肽聚糖合成途径PSP)为目标靶点,开发了具有多靶点组合调控能力的crRNA 阵列文库,并将之命名为ScrABBLE(synthetic CRISPR RNA array blend for boosting and leading)装置。通过ScrABBLE装置介导的多途径组合优化调控,产生了数以千计的多途径组合调控文库(图4a-c)。
(3)在测试(Test)阶段,通过流式细胞荧光分选技术(Fluorescence activated Cell Sorting, FACS),筛选出了GlcN6P浓度显著提高的工程菌株(图1d,图4d-f),并对生物传感器响应、靶基因表达水平及相关代谢物浓度进行了分析。
(4)在学习(Learn)阶段,利用基于Michaelis-Menten方程的动力学模型模拟了工程菌株的改造后相关代谢物的浓度变化,并为相关实验提供了指导(图1e)。
此外,通过生成三种荧光蛋白的多维调控空间,验证了ScrABBLE装置在多基因组合优化调控中的通用性(图5)。作为应用验证,筛选得到的GlcN6P高产菌株也被用于N-乙酰氨基葡萄糖(GlcNAc)和N-乙酰甘露糖胺(ManNAc)的生物合成,GlcNAc产量达到183.9 g/L,ManNAc 产量提高了2.7倍(图6)。由于T7RNAP和CRISPR系统菌具有良好的通用性,上述策略也可被应用于其他菌株和产物的代谢调控。
上述研究工作得到了国家重点研发项目(2020YFA0908300, 2018YFA0900300)、国家自然科学基金(32021005, 32070085, 31930085)、博士后创新人才支持计划(BX2021113)、中国博士后科学基金(2021M701458)、江苏省自然科学基金(BK20221083)、中央高校基本科研专项资金(USRP52019A, JUSRP121010, JUSRP221013)等项目的资助。
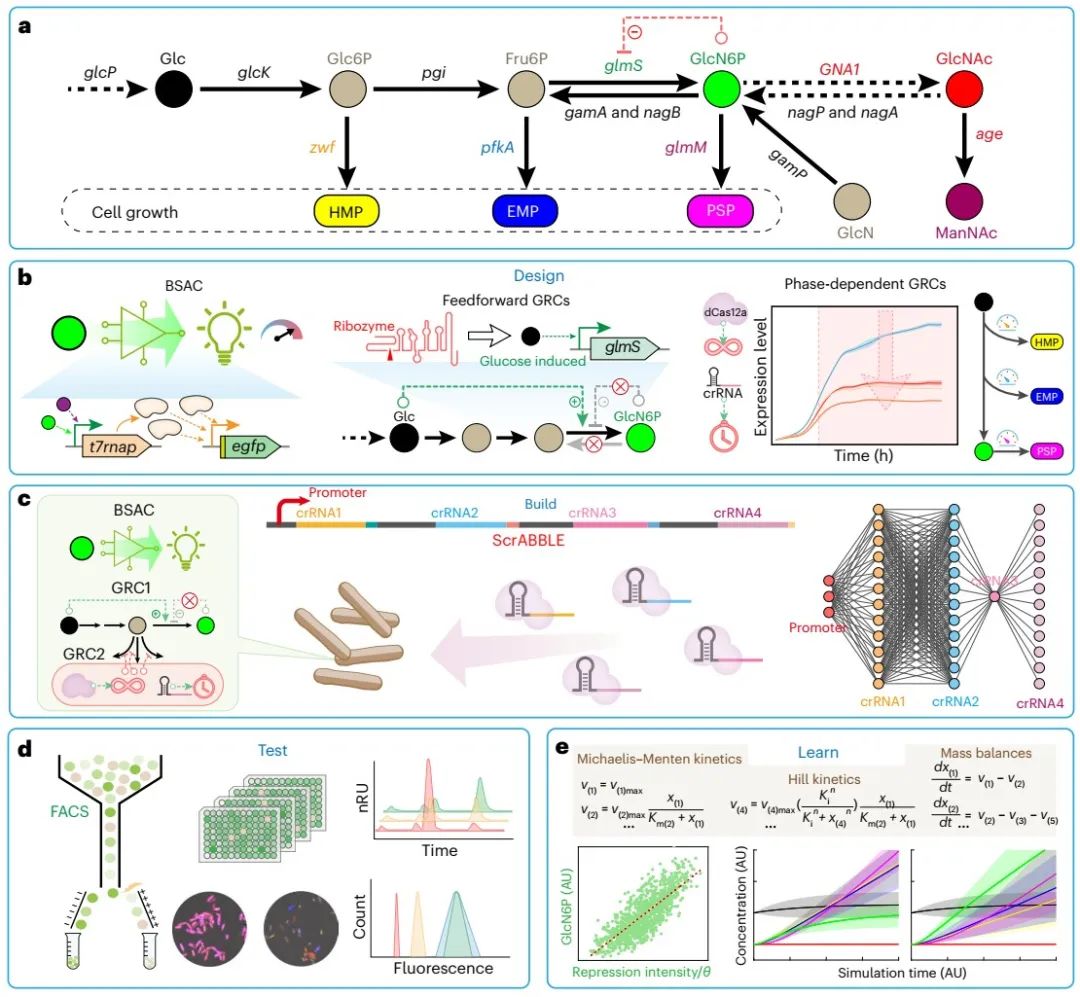
图1 本研究提出的“设计-构建-测试-学习(Design-Build-Test-Learn)”框架
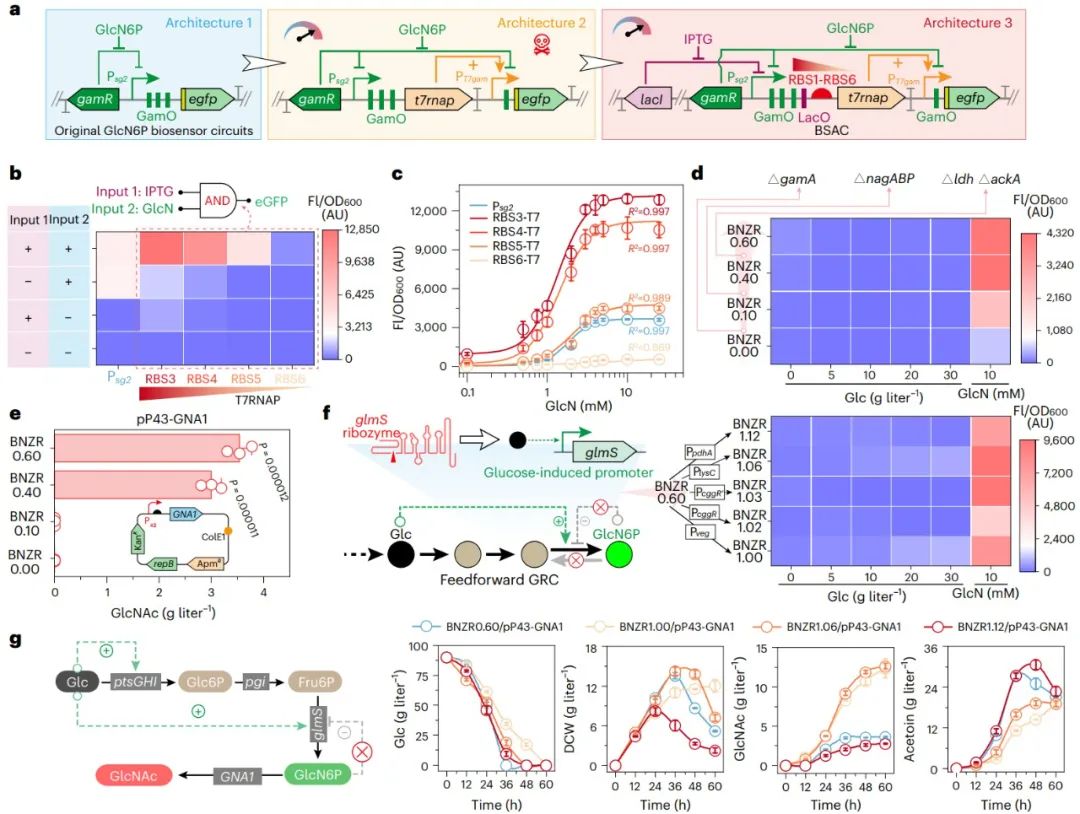
图2 BSAC与正反馈GRC的设计与表征
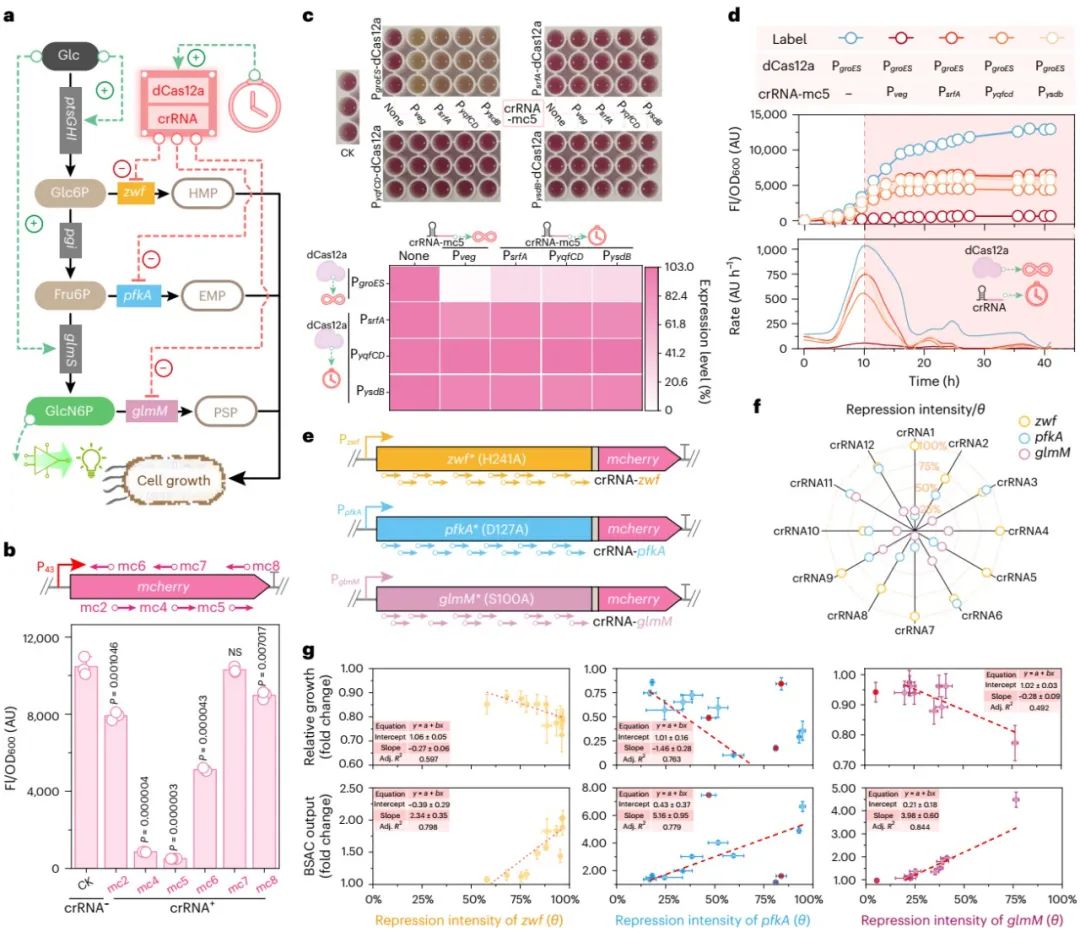
图3 时期依赖型GRC的设计与开发
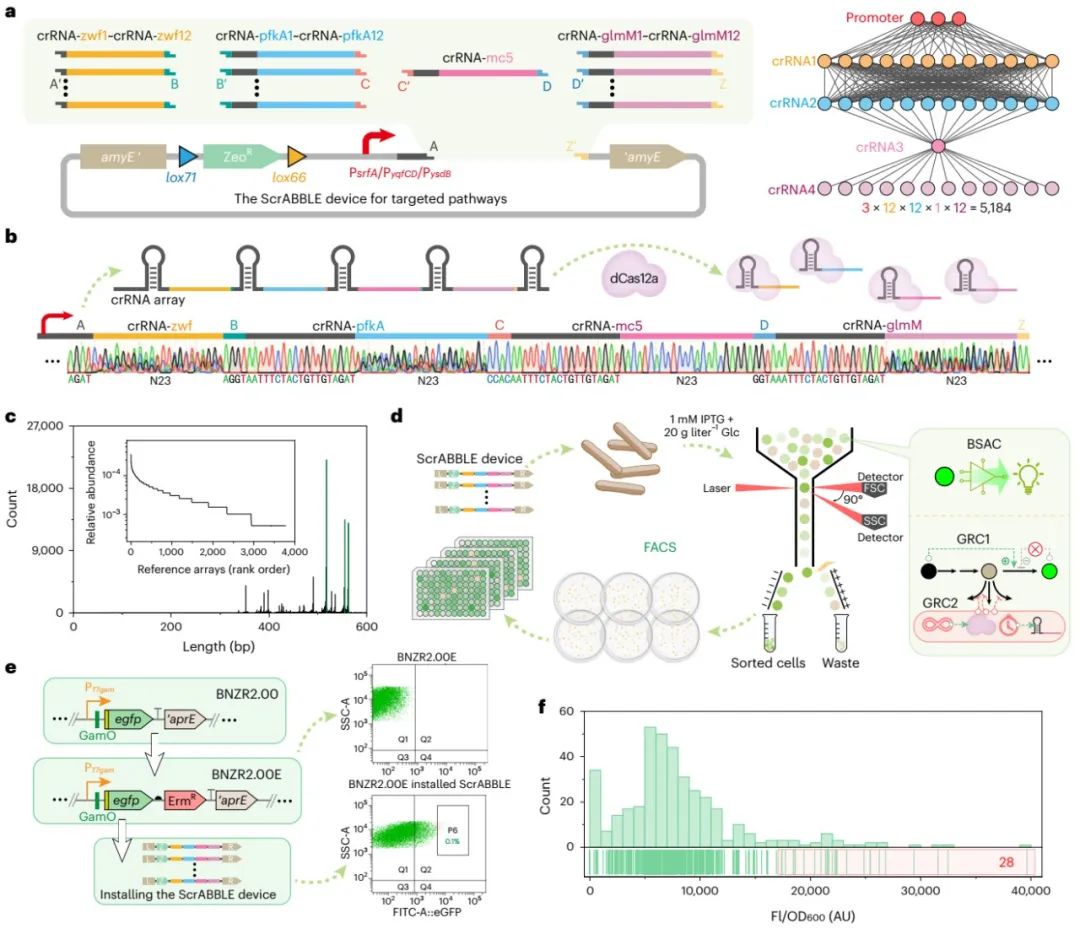
图4 ScrABBLE装置介导的多途径组合优化与高通量筛选
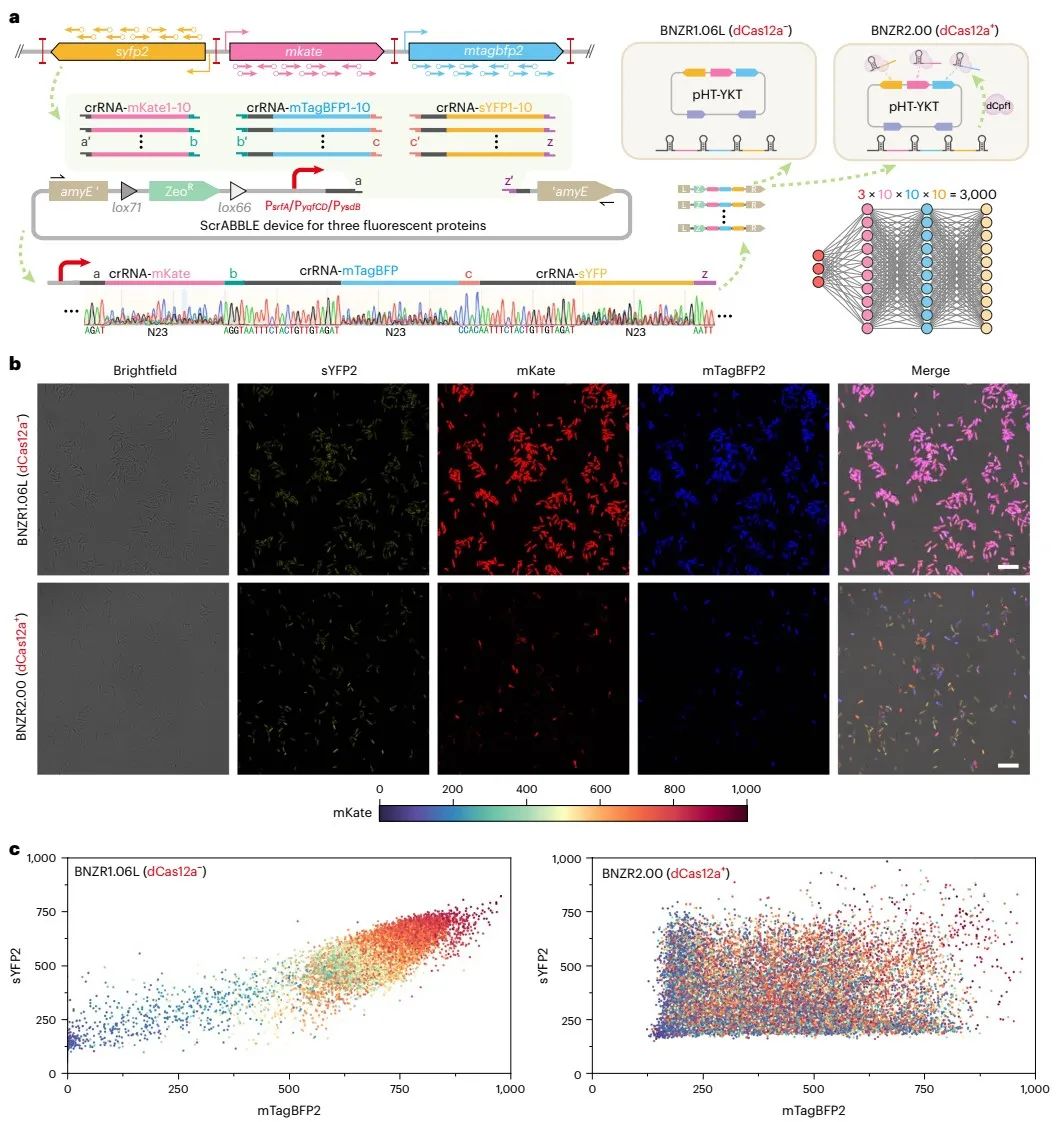
图5 ScrABBLE介导的多途径组合优化的通用性验证
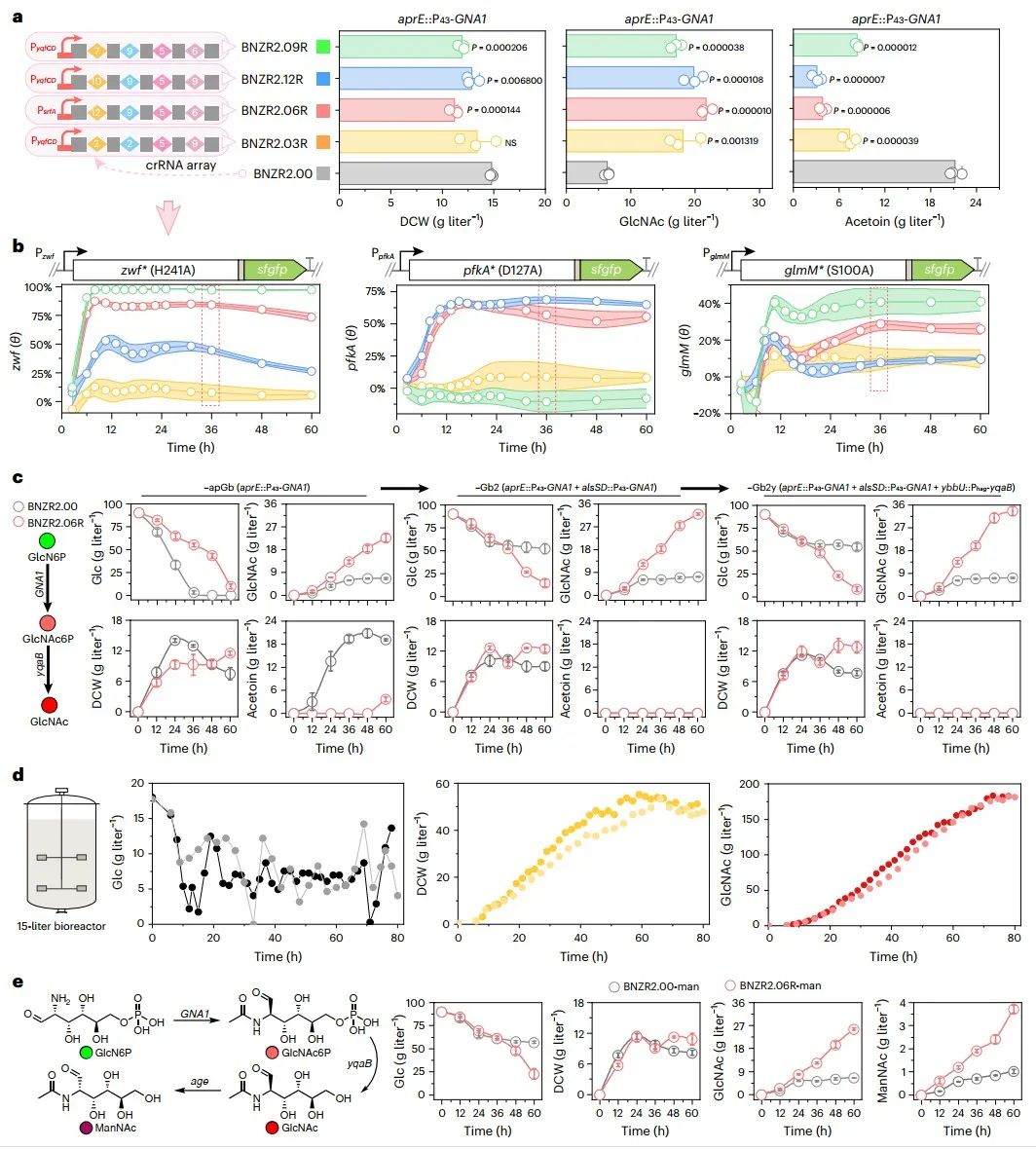
图6 重组菌株表征及其在GlcNAc与ManNAc合成中的应用
(编辑:潘梦妍)
