近日,Journal of Agricultural and Food Chemistry发表了江南大学未来食品科学中心陈坚院士团队刘延峰研究员课题组的研究成果“Metabolic Engineering of Escherichia coli for Increased Bioproduction of N‑Acetylneuraminic Acid” (Liu et al., J. Agric. Food Chem., 2022, 70(50):15859-15868. https://pubs.acs.org/doi/abs/10.1021/acs.jafc.2c05994)。江南大学2020级硕士刘畅为论文第一作者,刘延峰研究员为论文通讯作者,论文作者还包括堵国成教授、刘龙教授、李江华教授和吕雪芹副研究员。
N-乙酰神经氨酸(NeuAc)是唾液酸家族的重要代表,在生物识别、细胞免疫、疾病治疗和食品营养等方面发挥着重要作用。由于结构独特生理功能多样,具有抗菌排毒、抗粘附和抗癌的功能,NeuAc常被用于抗病毒药物扎那米韦等研究以及癌症的靶向治疗。此外,外源性膳食补充NeuAc有利于促进婴幼儿大脑的生长发育,增强记忆力和学习能力。由于NeuAc应用前景广阔,其生产策略成为多年来的研究热点。目前NeuAc的生产方式主要有天然产物提取法、化学合成法、酶催化法和全细胞催化法等,但存在操作繁琐,易造成环境污染,产物得率低,生产成本高等问题,限制了大规模的工业生产。相比而言,绿色、经济、高效、可持续的微生物发酵法更具吸引力。近年来尽管NeuAc从头合成策略的开发得到了有效进展,但产量仍具有很大的提升空间。目前,微生物发酵法合成NeuAc主要存在几个关键问题:(1)NeuAc代谢支路较多,产物合成易受到反馈抑制、分解代谢等不利因素的干扰;(2)代谢途径较长,反应冗杂,相关关键途径酶缺乏系统的研究与优化,易造成前体供应失衡;(3)竞争途径对碳流的争夺易导致目标途径碳通量不足,产率较低等。
针对以上问题,江南大学食品合成生物学与生物制造团队研究人员基于基因组的理性设计与定向改造,构建了一株以甘油为唯一碳源,从头合成NeuAc的高性能生产菌株,在3 L发酵罐实现了以甘油为底物发酵法合成NeuAc的最高产量。而且,在发酵过程中无需添加任何诱导剂和抗生素,有利于经济高效的工业化生产。首先,研究人员以大肠杆菌BL21(DE3)为出发菌株,阻断NeuAc的分解代谢途径,异源表达了来源于脑膜炎奈瑟氏菌(Neisseria meningitides)的编码UDP-GlcNAc差向异构酶的neuC基因,引入具有反馈抑制抗性的GlmS突变体,获得0.4 g/L的ManNAc(图1)。其次,该研究选择组成型启动子P1-P9,在转录水平上逐步优化NeuC酶的表达,将ManNAc产量进一步提高至1.78 g/L。此外,组合优化GlmM代谢模块和GlmU-GlmSA代谢模块的表达水平,设计了9种不同强度的UDP-GlcNAc供应模块,ManNAc的产量显著提升至8.95 g/L(图2)。
基于上述研究结果,研究人员进一步验证并优化了来源于Neisseria meningitides、Moritella viscosa和Escherichia coli三种不同微生物的编码N-乙酰神经氨酸合酶的neuB基因。基于不同表达强度的关键酶对NeuAc合成效率及细胞生长影响的分析,N. meningitidis来源的NeuB酶被确定为最佳来源,受到低强度启动子P1调控时NeuAc产量提升最高,达到6.27 g/L(图3)。此外,该研究通过组合敲除关键代谢节点相关基因manA、wecB和pykA阻断NeuAc竞争途径,NeuAc产量进一步提升至9.65 g/L(图4)。最后,在3 L发酵罐中,通过补料分批发酵,NeuAc产量达到23.46 g/L,生产强度为0.69 g/L/h,是目前以甘油为底物,发酵法合成NeuAc报道的最高产量(图5)。
上述研究工作得到了国家重点研发计划项目(2020YFA0908300)、国家优秀青年科学基金(32222069)和江苏省优秀青年科学基金(BK20200085)等项目的资助。
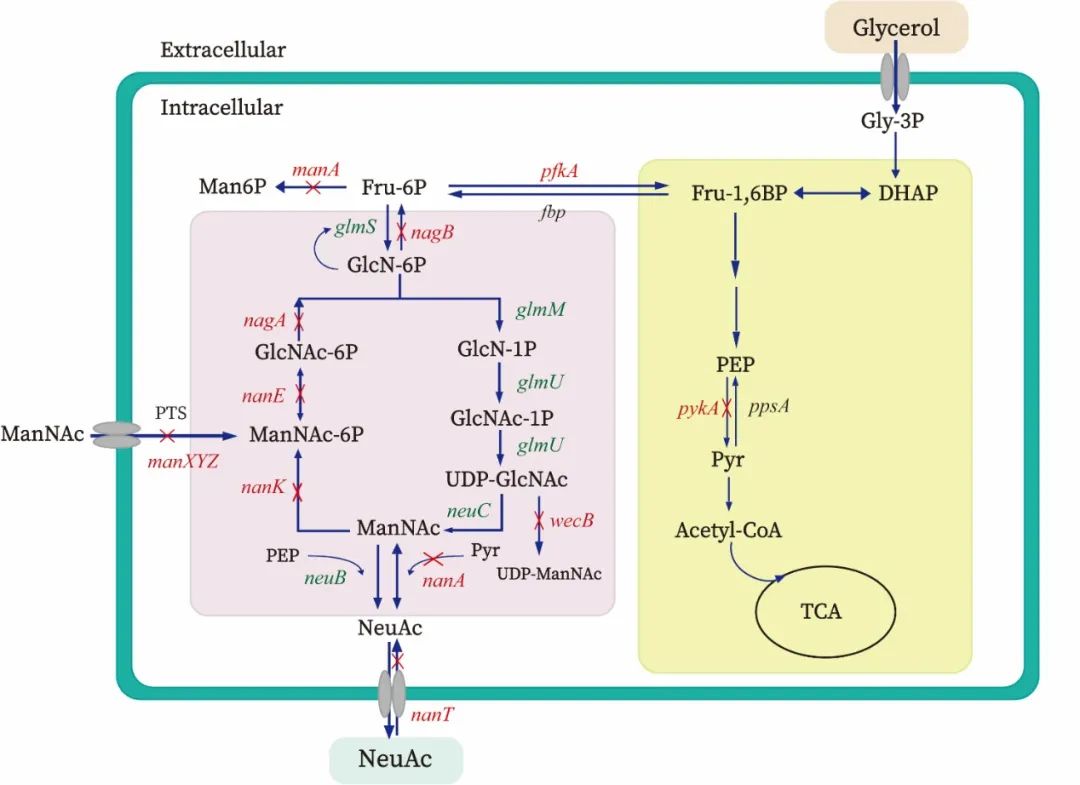
图1 大肠杆菌中NeuAc的生物合成途径
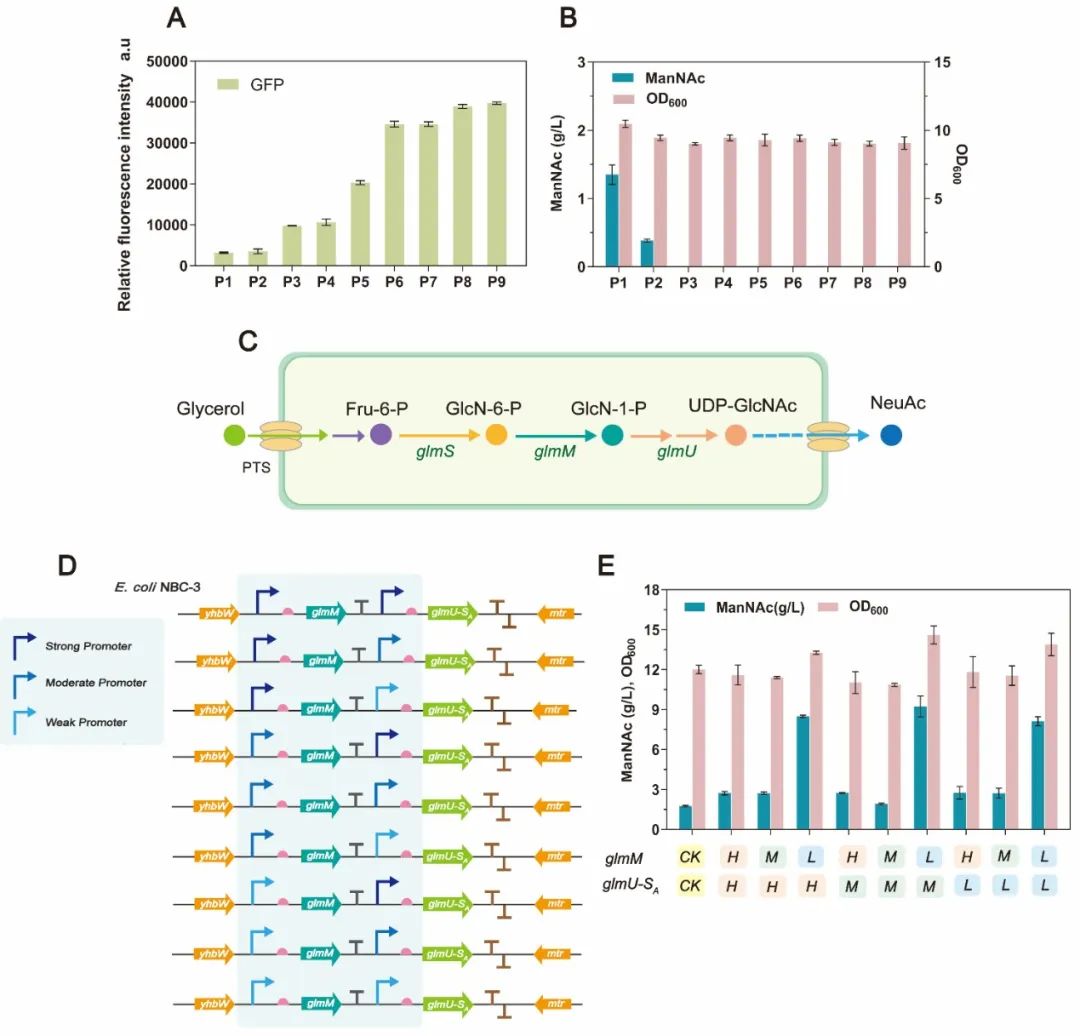
图2 NeuAc关键前体物质ManNAc的合成优化
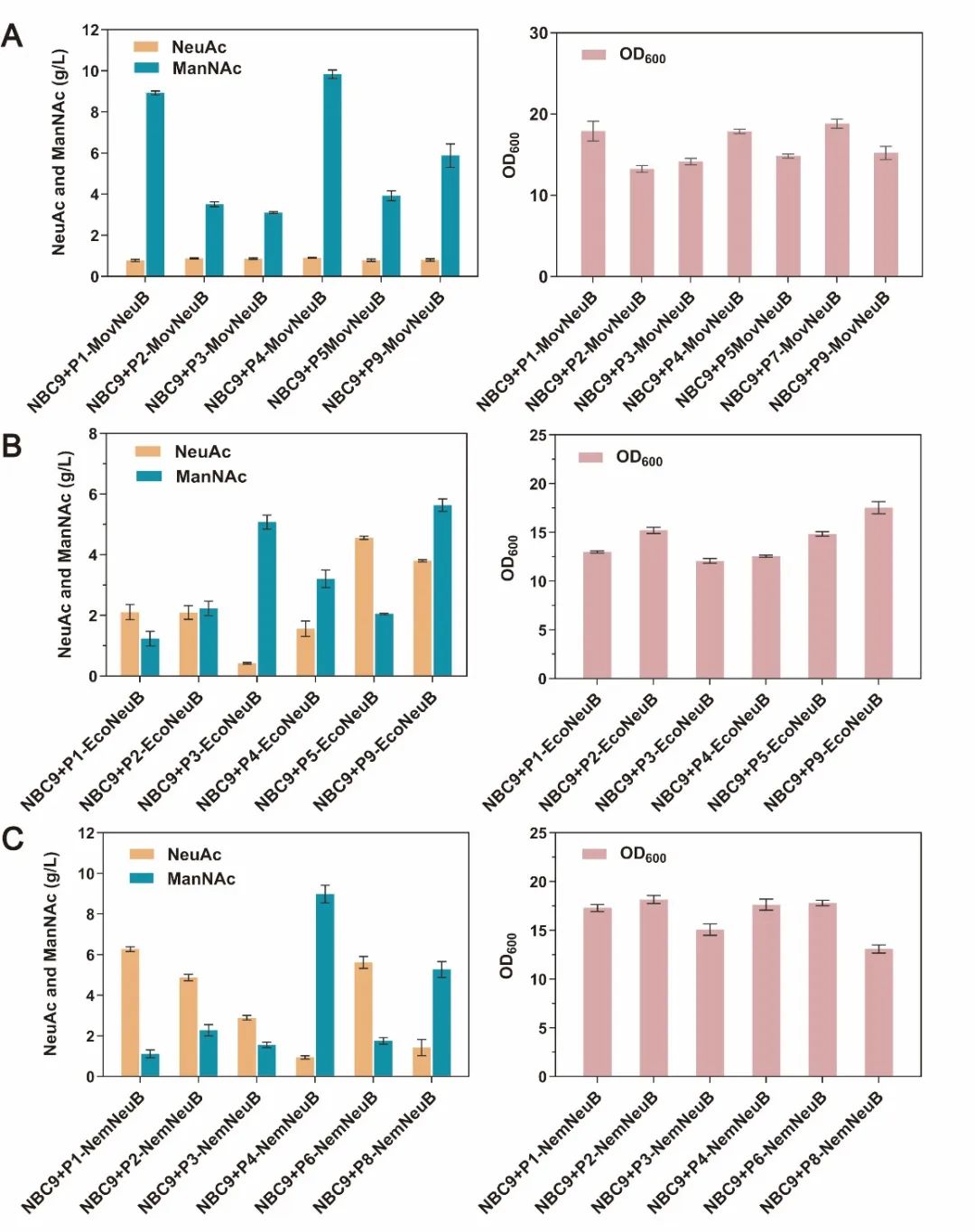
图3 优化不同来源的NeuB酶的表达水平对高效合成NeuAc的影响
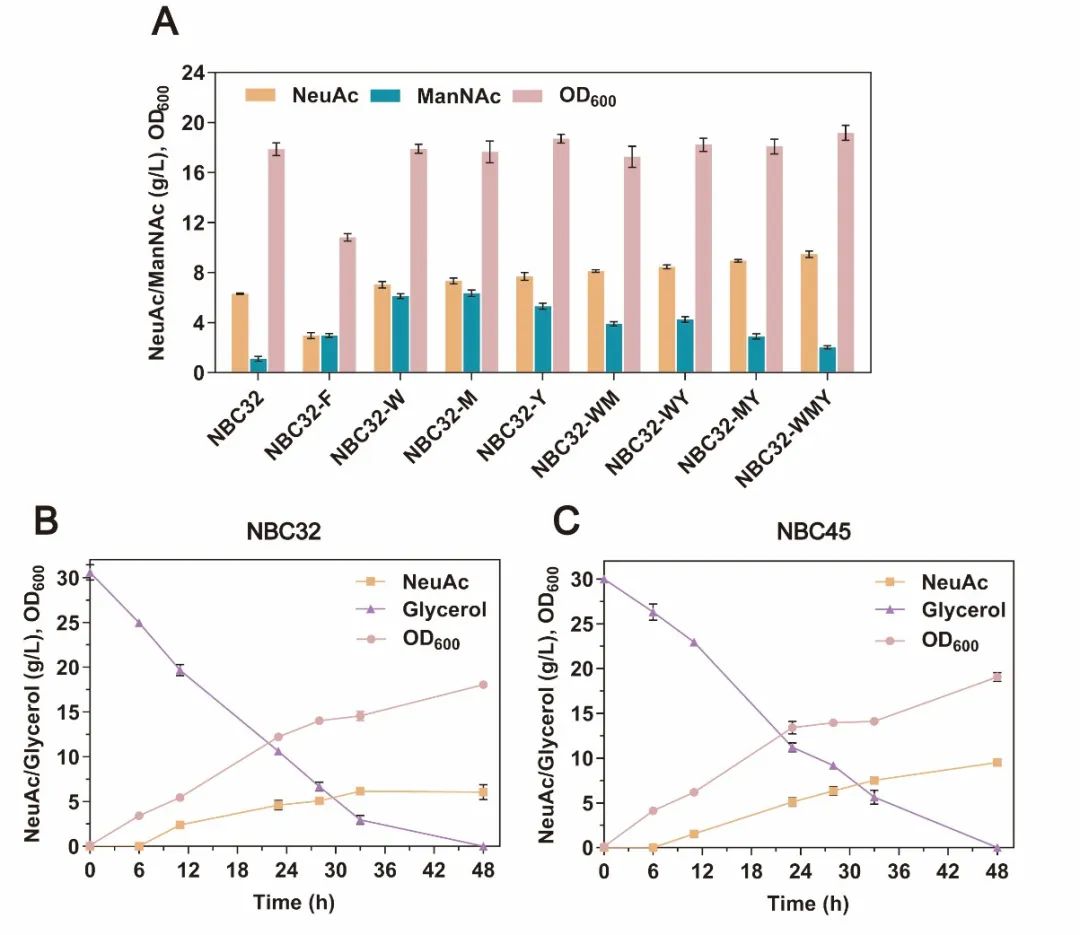
图4 竞争途径相关基因的敲除对NeuAc合成效率的影响
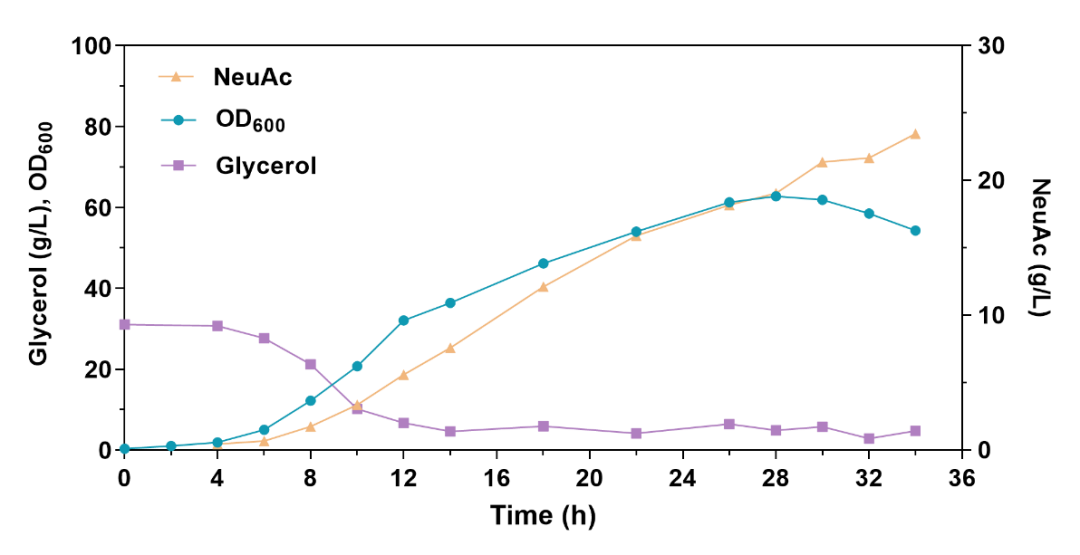
图5 3 L发酵罐中补料分批发酵
(编辑:潘梦妍)
