近日,我中心陈坚院士团队康振教授课题组在磺酸基供体再生与磺酸化修饰领域取得突破性进展。研究成果以“Engineering sulfonate group donor regeneration systems to boost biosynthesis of sulfated compounds”为题发表在杂志Nature Communications上(DOI:https://doi.org/10.1038/s41467-023-43195-1)。该论文第一作者是博士生胥睿睿,通讯作者是康振教授。
磺酸化修饰是一类重要的生物化学反应,与磷酸化、甲基化、乙酰化等修饰一样广泛存在生物体内。PAPS作为高能物质三磷酸腺苷ATP的同分异构体,一直以来被认为是生物体内所有生物磺酸化反应唯一的通用磺酸基团供体。课题组在前期创建了基于ATP等摩尔催化合成PAPS的闭路循环系统(突破了天然50%的理论转化率,ACS Catal. 2021. 16: 10405–10415),实现了PAPS的高效生物催化合成。然而,实现PAPS的再生循环利用是未来降低高附加值含磺酸基团化合物如肝素、硫酸软骨素(Green Chem. 2021. 23: 4365-4374; Green Chem. 2022. 24: 3180-3192; Carbohydr Polym. 2020.15: 116570)生物制造成本的关键。以往基于PNPS的PAPS再生系统存在底物昂贵、有毒物质PNP积累等问题,限制了其应用。如何建立绿色、低成本的磺酸基供体再生系统是生物制造产业亟需解决的难题。
课题组基于ATP再生模块、PAPS合成模块以及AMP再生模块三个模块的设计、验证、组装与适配,创建了以廉价的硫酸盐(SO42-)和聚磷酸(polyP6)为底物的PAPS人工再生系统,成功应用于一系列磺酸基化合物的生物催化合成,在降低成本的同时,显著提升了磺酸化效率(图1)。同时该系统可以在整合至活体细胞中并发挥作用,实现了Zosteric acid的全细胞催化。鉴于生物体内NADH与NADPH辅因子构效关系以及PAPS与前体APS在结构上的相似性,课题组研究人员提出APS可能也是一种磺酸基供体。通过分析大量磺酸基转移酶,首次证明了APS也是一种广谱的磺酸基供体,颠覆了传统认知,有望改写教科书相关知识(图2)。在发现APS作为广谱磺酸基供体基础上,研究人员进一步设计了路径更短的APS再生系统(3个酶)。为实现基于APS再生的高效磺酸化修饰,研究人员进一步设计构建了基于APS高活性的磺酸基转移酶高通量筛选体系,最终获得了APS高亲和力的磺酸基转移酶,实现了一系列磺酸基化合物的高效催化合成(图3)。
以上开创性研究为含磺酸基化合物的生物催化合成与功能研究提供了借鉴和支撑,也加深了人类对生物体磺酸化修饰的生物学调控的理解。本工作得到国家自然科学基金(32370066)、国家重点研发项目(2021YFC2100800)、江南大学双一流学科与支撑学科协同发展支持计划项目(QGJC20230202)的支持。
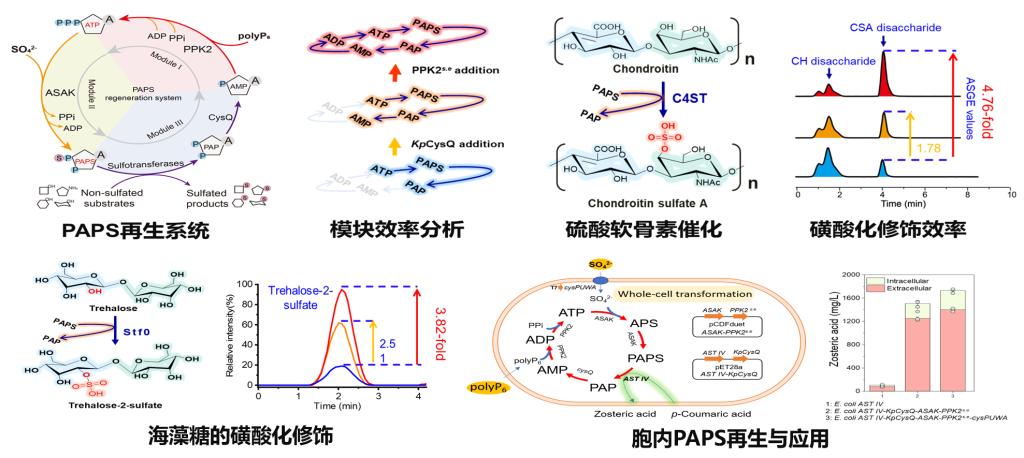
图1 PAPS再生系统与催化应用
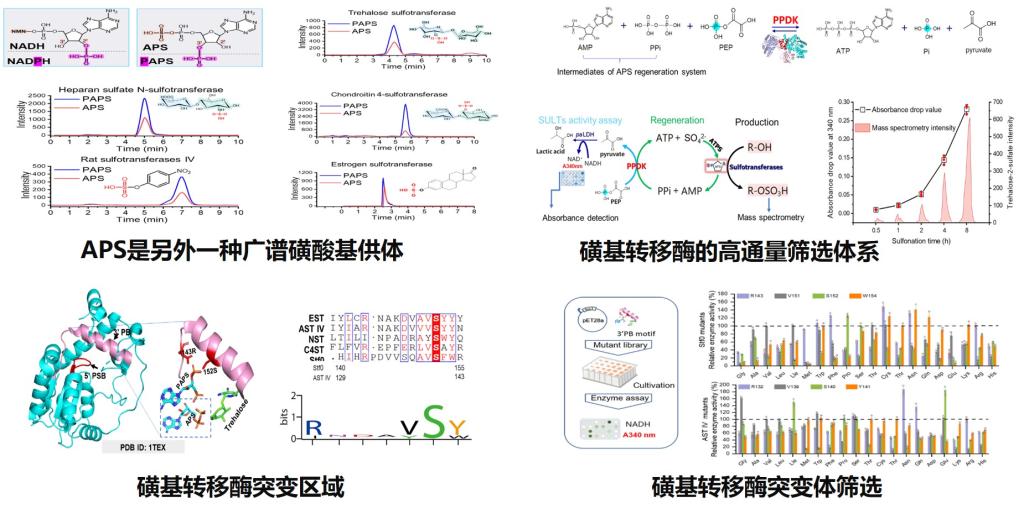
图2 APS磺酸基供体验证与高APS活性磺基转移酶筛选

图3 APS再生系统与应用
(编辑:潘梦妍)
